水は気圧と温度によって気相、液相、固相に分かれる。ただし相が変化するときに2つの相が混在することがある。液相と気相が混在して安定した状態を相平衡にあるという。液相から気相への変化は蒸発といい、その逆は凝縮という。相平衡にあるときは蒸発速度と凝縮速度が等しい状態にあるといえる。さて、下図①のように容器の中に20℃の水を入れて、大気圧p=101.25kPa(1気圧)がかかるようにしよう。この時の水の状態を圧縮液の状態という。
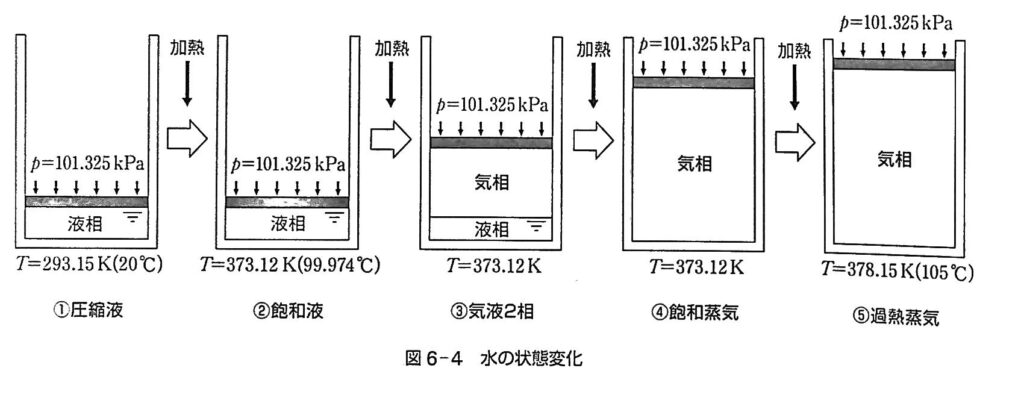
この圧縮液の水を100℃まで加熱していくと、体積は変化せずに(実は4%増加する)水温だけが変化する。この温度を変化させる熱量を顕熱という。必要な熱量Q=mcΔTで表す。mは水の質量、cは比熱(=4.2kJ/(kgK))、ΔTは温度差である。この気圧の下100℃(厳密には99.974℃)に達すると、一部が水蒸気となって出はじめる。この②の状態の水を飽和液という。ただし、飽和液の状態では水蒸気量は0である。しかし、加熱し続けると水蒸気が出始め、空間内は水の液相と水蒸気の気相が混在するようになる。この③の気液2相の状態を湿り蒸気という。加熱を続けると飽和液の量が減り、その分水蒸気の量が増えていく。しかし温度は100℃のままである。さらに過熱を続けると飽和液がすべて水蒸気に変わってしまう。この④の時の水蒸気を飽和蒸気という。この間温度は100℃のままである。加熱をしているので熱量は投入しているのであるが、温度が変わらないのは相が変化するのに必要な熱量が温度上昇に使われなく、相変化に使用されるということになる。この熱量を潜熱という。質量1kgの飽和液すべてが蒸気に変わるのに必要な潜熱は r=2246.47 [kJ/kg ] である。さらに過熱を続けると、顕熱で水蒸気の温度は上昇する。この⑤の時の水蒸気を過熱蒸気という。
湿り蒸気の質量mは飽和水の質量mwと飽和蒸気の質量mvの和で表される。湿り上にの質量に対する飽和蒸気の質量の割合を「乾き度」という。それをxで表す。したがって、x=mv/m である。名前としては滑稽な、湿り蒸気の乾き度という。飽和液の状態ではmv=0なので、x=0である。逆に飽和蒸気の状態ではmv=mなので、乾き度1である。つまり飽和蒸気は乾き度=1の蒸気ということを表している。逆の言い方をすれば、飽和水が混ざっていれば湿っているのである。